
Ikatan kovalen adalah ikatan yang terjadi akibat pemakaian pasangan electron secara bersama-sama oleh dua atom (James E. Brady, 1990). Ikatan kovalen terbentuk di antara dua atom yang sama-sama ingin menangkap elektron (sesama atom bukan logam).
Cara atom-atom saling mengikat dalam suatu molekul dinyatakan oleh rumus bangun atau rumus struktur. Rumus struktur diperoleh dari rumus Lewis dengan mengganti setiap pasangan elektron ikatan dengan sepotong garis. Misalnya, rumus bangun H2 adalah H – H
Macam - macam Ikatan Kovalen :
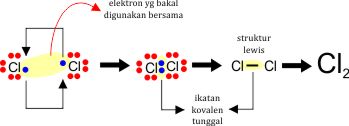
1). Ikatan Kovalen Tunggal
Merupakan ikatan kovalen dengan jumlah pasangan elektron yang digunakan bersaam berjumlah satu pasang. Contohnya ikatan pada beberapa senyawa diatomik dari unsur golongan 7 seperti Cl2, Br2, dan F2. Berikut mekanisme pembentukan ikatan kovalen tunggal pada Cl2
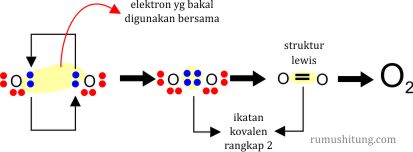
2). Ikatan Kovalen Rangkap Dua
Kalau kovalen tunggal jumlah pasangan elektron yang digunakan bersama adalah sepasang (2 buah elektron), dalam ikatan kovalen rangkap dua ada dua pasang (4 buah) elektron yang digunakan bersama. Contohnya pada senyawa oksigen (O2)
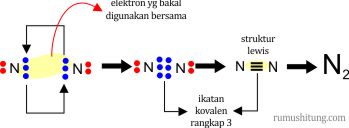
Kalau ditanya berpa jumlah pasangan elektron yang digunakan dalam ikatan kovalen rangkap 3 jawabannya adalah 3 pasang (6 buah elektron). Contohnya pada pembentukan senyawa diatomik dari N2.

- Ikatan kovalen pada F2
Pada ikatan kovalen rangkap dua[sunting | sunting sumber]
Pada ikatan kovalen rangkap dua, ditunjukkan oleh garis rangkap dua (=), yang artinya terdapat dua pasangan elektron ikatan, contohnya pada ikatan rangkap dua pada molekulCO2.
- Ikatan ion pada NaCl
Atom Na memberikan 1 elektronnya pada atom Cl, sehingga Na bermuatan positif dan Cl bermuatan negatif. Keduanya telah memenuhi kaidah oktet.
- Ikatan ion pada MgO
Atom Mg memberikan 2 elektronnya pada atom O, sehingga Mg bermuatan positif 2 dan O bermuatan negatif 2. Keduanya telah memenuhi kaidah oktet.
struktur lewis
Langkah-langkah dalam menggambarkan struktur Lewis:
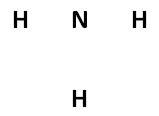
- Menghitung valensi atom yang akan dibuat struktur Lewisnya, contoh NH3.
- Membuat kerangka strukturnya, di mana atom pusatnya biasanya adalah atom pertama dalam rumus kimia molekul tersebut.
- Menempatkan satu elektron pada sisi di mana terdapat atom lain. Jika terdapat sisa elektron, letakkan elektron-elektron tersebut secara berpasangan.
- Menulis semua elektron valensi dari atom-atom yang terlibat dengan menggunakan lambang titik (•).
- Melengkapi bentuk duplet atau oktet dari ikatan atom ke atom pusat.
- Bila atom pusat masih belum memenuhi kaidah oktet maka dapat digunakan ikatan rangkap agar setiap atom dapat memenuhi oktet.
- Jika sudah sesuai, ganti setiap pasangan elektron tersebut dengan garis tunggal (ikatan tunggal). Apabila terdapat dua pasangan elektron, maka ganti dengan garis rangkap dua (ikatan rangkap dua). Jika terdapat 3 pasangan elektron, ganti dengan garis rangkap tiga (ikatan rangkap tiga).
PENYIMPANGAN KAIDAH OKTET
Beberapa senyawa ternyata mempunyai Struktur Lewis yang menyimpang dari kaidah Oktet.
1. Spesies Ganjil
1. Spesies Ganjil
Pengertian
Jika jumlah elektron valensi di dalam struktur lewis ganjil, maka ada elektron yang tidak berpasangan sehingga atom menyimpang dari kaidah oktet. Contoh : Molekul NO2 , dimana jumlah electron valennsi molekul adalah 17 (ganjil). Jumlah electron Valensi N adalah 7 (menyimpang dari kaidah Oktet)
Jika jumlah elektron valensi di dalam struktur lewis ganjil, maka ada elektron yang tidak berpasangan sehingga atom menyimpang dari kaidah oktet. Contoh : Molekul NO2 , dimana jumlah electron valennsi molekul adalah 17 (ganjil). Jumlah electron Valensi N adalah 7 (menyimpang dari kaidah Oktet)
2. Oktet Tak Lengkap
Pengertian
Jika jumlah electron valensi didalam struktur lewis genap namun jumlahnya kurang dari 8 (octet) , maka struktur lewis dapat dinyatakan sebagai oktet tak lengkap dan termasuk struktur lewis yang menyimpang dari kaidah oktet. Contohnya BeCl2 dan BH3.
Jika jumlah electron valensi didalam struktur lewis genap namun jumlahnya kurang dari 8 (octet) , maka struktur lewis dapat dinyatakan sebagai oktet tak lengkap dan termasuk struktur lewis yang menyimpang dari kaidah oktet. Contohnya BeCl2 dan BH3.
3. Oktet Berkembang
Pengertian
Jika jumlah electron valensi dalam struktur lewis genap dan jumlah lebih dari delapan ( oktet) , maka struktur lewis tersebut dinyatakan sebagai octet berkembang dan termasuk struktr lewis yang menyimpang dari kaidah oktet. Contohnya PCl3, SF6.
Kepolaran Ikatan
Didalam molekul HCl ternyata pasangan elektron yang dipergunakan bersama lebih tertarik kepada Cl, karena atom Cl lebih kuat menarik elektron dari pada atom H (Cl lebih elektronegatif dari pada H). Akibatnya dalam molekul HCl terbetuk dwi kutub (bersifat polar). Ikatan kovalen semacam ini disebut ikatan kovalen polar. Kepolaran senyawa akan bertambah jika beda keelektronegatifan atom-atom yang berikatan semakin besar.Seperti yang diketahui hakikat ikatan kovalen, yaitu ikatan yang terbentuk karena menggunakan pasangan elektron bersama. Namun demikian, kedudukan pasangan elektron milik bersama itu tidak selalu simetris terhadap kedua atom yang berikatan. Pasangan elektron akan lebih dekat ke arah atom yang mempunyai keelektronegatifan lebih besar. Hal ini mengakibatkan polarisasi atau pengutuban ikatan.
Dalam molekul H2 kedudukan pasangan elektron ikatan sudah pasti simetris terhadap kedua atom H. Dalam molekul H2 tersebut, muatan negatif (elektron) tersebar secara homogen. Ikatan seperti itu disebut ikatan kovalen nonpolar. Sedangkan pada HCl, pasangan elektron ikatan tertarik lebih dekat ke atom Cl,
karana Cl mempunyai daya tarik elektron lebih besar daripada H. Akibatnya, pada HCl terjadi polarisasi, dimana atom Cl lebih negatif dari atom H. Ikatan seperti itu disebut ikatan kovalen polar.
Molekul Polar dan Non-polar
Kepolaran molekul ditentukan oleh jenis ikata kovalen dan bentuk molekulnya . Suatu molekul akan bersifat polar jika memenuhi syarat sebagai berikut :
a. molekul dwiatom yang berbeda jenis sehingga membentuk kutub (dipol) karena adanya perbedaan keelektronegatifan antar kedua atom.
b. molekul poliatom yang mempunyai bentuk atom yang tidak simetris ,sehingga pusat muatan positif tidak berimpit dengan pusat muatan yang negatif
CH4, BF3, SiO2, CO2 ikatan antar atomnya adalah ikatan kovalen polar, tetapi molekul molekul tersebut bersifat non polar.
H2O, NH3, PCl3 ikatan antar atomnya kovalen polar dan molekul bersifat polar.





Apakah ikatan kovalen tunggal hanya terjadi pada senyawa diatomik saja? Atau bisa terjadi pada senyawa-senyawa lainnya?jika ia bisakah anda memberikan contoh nya?
BalasHapusya , ini hanya berlaku pada molekul diatomik saja .karena ikatan kimia yang memiliki karakteristik berupa pasangan elektron yang saling terbagi (pemakaian bersama elektron) di antara atom-atom yang berikatan. Singkatnya, stabilitas tarikan dan tolakan yang terbentuk di antara atom-atom ketika mempergunakan bersama elektron dikenal sebagai ikatan kovalen.
BalasHapusya , ini hanya berlaku pada molekul diatomik saja .karena ikatan kimia yang memiliki karakteristik berupa pasangan elektron yang saling terbagi (pemakaian bersama elektron) di antara atom-atom yang berikatan. Singkatnya, stabilitas tarikan dan tolakan yang terbentuk di antara atom-atom ketika mempergunakan bersama elektron dikenal sebagai ikatan kovalen.
BalasHapusSaya tidak mengerti,coba anda jelaskan dngn bahasa yg mdh dipahami.
BalasHapusKepolaran senyawa akan bertambah jika beda keelektronegatifan atom-atom yang berikatan semakin besar.
BalasHapusCoba jelaskan donk bagaimana cara kita menentukan keelektronegatifan sebuah atom?